Sisältö
- Tärkein ero
- Vertailutaulukko
- Mitä ioniyhdisteet ovat?
- Mitä ovat molekyyliyhdisteet?
- Ioniyhdisteet vs. molekyyliyhdisteet
Tärkein ero
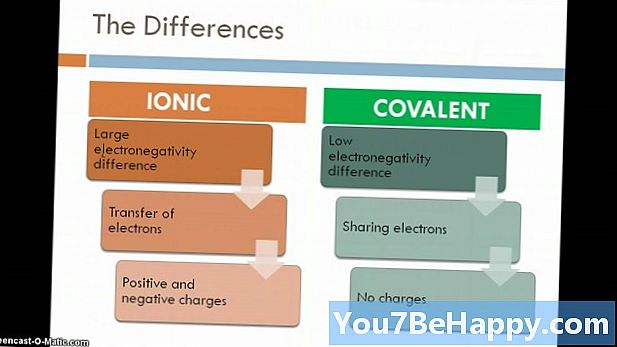
Yhdiste tunnistetaan aineeksi, joka muodostuu, kun kaksi tai useampia alkuaineita yhdistyvät tietyissä suhteissa kemiallisen sidoksen kautta. Ioniyhdiste on yhdiste, joka muodostuu metallien ja ei-metallien välisestä sähköstaattisesta vetovoimasta. Ioniyhdisteet esiintyvät yleensä myytynä kiteisessä tilassa. Lisäksi ioniset yhdisteet ovat hyviä sähkönjohtajia ja niillä on korkea sulamis- ja kiehumispiste. Toisaalta, molekyyliyhdisteitä muodostuu johtuen elektronien jakautumisesta kahden ei-metallin välillä. Ioniyhdisteeseen verrattuna ne ovat heikko sähkönjohtajia ja niillä on alhainen sulamis- ja kiehumispiste.
Vertailutaulukko
| Ioniyhdisteet | Molekyyliyhdisteet | |
| Muodostus | Ioniyhdisteet muodostuvat metallien ja ei-metallien välisestä sähköstaattisesta vetovoimasta. | Molekyyliyhdisteitä muodostuu johtuen elektronien jakautumisesta kahden ei-metallin välillä. |
| Ryhmä | Ioniyhdisteet muodostuvat metallin ja ei-henkisten välillä. | Molekyyliyhdisteet muodostuvat, kun kaksi ei-metallia yhdistyvät kemiallisesti |
| side | Ioniyhdiste muodostuu sähköstaattisesta vetovoimasta, joka tunnetaan nimellä ioninen sidos. | Molekyyliyhdisteitä muodostuu elementtien välisten kovalenttisten sidosten vuoksi. |
| Sulamis- ja kiehumispiste | Korkea | Matala |
| Osavaltio | Ioniyhdisteet ovat aina kiinteässä tilassa muodostaen kiteisen ulkonäön. | Molekyyliyhdisteet voivat olla missä tahansa tilassa, kiinteitä, nestemäisiä tai kaasuja huoneenlämpötilassa. |
| Sähkönjohdin | Hyvä | Huono |
Mitä ioniyhdisteet ovat?
Nämä yhdisteet muodostuvat metallien ja ei-metallien välisen sähköstaattisen vetovoiman takia. Yksinkertaisemmin sanottuna voima (ioninen sidos) tässä saa positiivisesti ja negatiivisesti varautuneen reagoimaan yhdessä yhdisteen muodostamiseksi. Ioniyhdisteet esiintyvät yleensä myytynä kiteisessä tilassa ja ovat hyviä sähkönjohtajia, joilla on korkeat sulamis- ja kiehumispisteet. Ioniyhdisteet muodostuvat metallien ja ei-metallien välille, ja niiden muoto on kiiltävä.
Esimerkki: Pöytäsuola (NaCl) on yleisin esimerkki ionisesta yhdisteestä. Tässä muodostumisessa natrium (NA) on metalli, kun taas kloori (Cl) on ei-metalli, molemmat pidetään yhdessä molempien välisen sähköstaattisen vetovoiman takia.
Mitä ovat molekyyliyhdisteet?
Yhdisteet, jotka muodostuvat elektronien jakautumisesta ei-metallien välillä, tunnetaan nimellä molekyyliyhdiste. Tässä reagoivat elementit pidetään yhdessä kovalenttisen sidoksen takia, ja siksi näitä yhdisteitä kutsutaan usein kovalenttisiksi yhdisteiksi.Ioniyhdisteeseen verrattuna ne ovat heikko sähkönjohtajia ja niillä on alhainen sulamis- ja kiehumispiste.
Esimerkki: Otsonissa (O3) happi yhdistyy elektronien jakamiseen otsoniksi.
Ioniyhdisteet vs. molekyyliyhdisteet
- Ioniyhdisteet muodostuvat metallien ja ei-metallien välisestä sähköstaattisesta vetovoimasta, kun taas molekyyliyhdisteet muodostuvat elektronien jakautumisesta kahden ei-metallin välillä.
- Molekyyliyhdisteet muodostuvat, kun kaksi ei-metallia yhdistyvät kemiallisesti, ja toisaalta ioniset yhdisteet muodostuvat metallin ja ei-henkisen välillä.
- Molekyyliyhdisteitä muodostuu elementtien välisestä kovalenttisesta sidoksesta, kun taas ioninen yhdiste muodostetaan ioniseksi sidokseksi kutsutun sähköstaattisen vetovoiman vuoksi.
- Molekyyliyhdisteillä on alhainen sulamis- ja kiehumispiste verrattuna ionisiin yhdisteisiin.
- Molekyyliyhdisteet voivat olla missä tahansa tilassa, kiinteitä, nestemäisiä tai kaasuja huoneenlämpötilassa, kun taas ioniset yhdisteet ovat aina kiinteässä tilassa muodostaen kiteisen ulkonäön.
- Molekyyliyhdisteet ovat huonosti sähkönjohtajia, kun taas ioniset yhdisteet ovat hyviä sähkönjohtajia.